Sheinbaum lanza plan para atraer farmacéuticas extranjeras y producir medicamentos en México

La presidenta Claudia Sheinbaum anunció que esta semana se publicará en el Diario Oficial de la Federación (DOF) un decreto que busca incentivar la inversión de empresas farmacéuticas internacionales en el país, con la mira puesta en que, a partir de 2026, comiencen a instalarse plantas productoras de medicamentos e insumos médicos en territorio nacional.
El anuncio forma parte del llamado Plan México, y tiene como eje central el fortalecimiento de la producción nacional de insumos para el sector salud.
Según lo planteado por la mandataria federal, el decreto buscará que empresas de países como India, Estados Unidos, Brasil, así como naciones de Europa y América Latina, apuesten por establecer operaciones en México.
“Queremos que produzcan aquí los medicamentos, eso va a ser que sean todavía más económicos; y además, se va a generar empleo”, aseguró Sheinbaum en su conferencia matutina.
Sheinbaum busca que México sea un referente en la producción de medicamentos y vacunas, con el impulso de laboratorios como Birmex y bioincubadoras en polos de desarrollo económico
Birmex: pieza clave para la soberanía farmacéutica
Una de las vías que se contempla para canalizar estas inversiones será a través de los Polos de Desarrollo Económico para el Bienestar (PODECOBI), una red de regiones con incentivos especiales.
Asimismo, el decreto establece una articulación estratégica con Laboratorios de Biológicos y Reactivos de México (Birmex), empresa pública que durante décadas fabricó vacunas y biológicos en el país, pero que perdió gran parte de su capacidad operativa durante el llamado periodo neoliberal.
“Queremos que todo esto esté vinculado con Birmex, que tiene muchísimas instalaciones con capacidad. Lo que se va a publicar es para que, en la compra del 2026, que va a ser para 2027 y 2028, ya vengan puntos de calificación a todos los que van a participar en las licitaciones, adquisiciones, invitaciones, para que tengan plantas instaladas en México”, explicó Sheinbaum.
Ventajas para quienes produzcan en México
El criterio clave es que, al participar en procesos de compra pública —uno de los principales mecanismos de adquisición de insumos médicos del país— las empresas que cuenten con instalaciones productivas en México tengan una ventaja competitiva.
La idea es que se reconozca no sólo la calidad de los productos y los precios, sino también la inversión y el arraigo productivo que estas empresas tengan en el territorio nacional.
De acuerdo con cifras de la Secretaría de Salud, el gobierno federal realiza cada dos años una compra consolidada de medicamentos e insumos médicos que ronda los 300 mil millones de pesos.
En este contexto, el subsecretario de Integración y Desarrollo del Sector Salud, Eduardo Clark García Dobarganes, explicó que el nuevo decreto establecerá criterios diferenciados según el tipo de medicamento.
Medicamentos sin patente y de patente: reglas distintas
Para medicamentos sin patente, se otorgarán puntos a las empresas que acrediten inversión física en México, ya sea mediante la instalación de fábricas, plantas de cadena de suministros, laboratorios o almacenes.
En el caso de medicamentos de patente o fuente única, las negociaciones incluirán un componente de compromiso de inversión proporcional al monto adquirido por el Estado, con el objetivo de asegurar una presencia productiva sostenida en el país.
Además, se anunció la creación de una Comisión de Promoción a la Inversión Farmacéutica, instancia que coordinará las estrategias gubernamentales para atraer capital internacional y vincularlo con el desarrollo del sector salud en México.
En términos de innovación y desarrollo científico, el secretario de Salud, David Kershenobich Stalnikowitz, informó que el plan contempla la instalación de bioincubadoras, espacios donde empresas, universidades y centros de investigación puedan colaborar en el desarrollo de medicamentos, vacunas y dispositivos médicos.
Según explicó, este enfoque también buscará fortalecer la industria química, la ingeniería biomédica y la protección de la propiedad intelectual.
Por su parte, la titular de la Cofepris, Armida Zúñiga Estrada, explicó que uno de los elementos para el éxito del decreto será la modernización de la agencia reguladora.
Indicó que actualmente se trabaja en la digitalización total de los trámites, con un avance del 60 por ciento, gracias al apoyo de la Agencia de Transformación Digital y Telecomunicaciones (ATDT).
También se ha reducido el tiempo de respuesta en la evaluación de investigaciones clínicas, y se ha actualizado la plataforma DIGIPRiS para mejorar la gestión de ensayos clínicos.
Además, Cofepris está revisando el marco normativo aplicable a medicamentos y dispositivos médicos, y ha establecido una colaboración estratégica con el Instituto Mexicano de la Propiedad Industrial (IMPI) para agilizar los procesos de registro sanitario y de patentes.
Este conjunto de medidas, de acuerdo con Zúñiga Estrada, busca que Cofepris opere con estándares internacionales, de manera más transparente, eficaz y armonizada.
Aunque aún no se ha detallado cuántas empresas han mostrado interés o qué montos se prevén en inversiones, el gobierno federal apuesta a que, con la señal de certeza que dará el decreto, y con el volumen de compras públicas como incentivo, México se convierta en un polo atractivo para la producción farmacéutica internacional.
Tips al momento

Una presidenta rencorosa hasta para dar condolencias
Más lamentable no pudo haber sido el posicionamiento de la presidenta Claudia Sheinbaum en la mañanera, después de la tragedia que ocurrió el fin de semana con la ejecución del alcalde de Uruapan, Michoacán, Carlos Manzo.
Primero, su lenguaje corporal no ocultó cuando dio las condolencias su enorme enojo por haberlas dado en esa situación, lo cual resulta condenable viniendo de quién es la responsable del país, en medio de una nación llena de sangre y donde cada vez la situación se vuelve más peligrosa por tanto activista asesinado que se atreve a levantar la voz contra el gobierno y con su convivencia y parálisis y complacencia con la delincuencia organizada.
Segundo, resulta ser "que la derecha" es la que está detrás de todas las críticas y de los comentócratas, algo falaz viniendo de alguien que debería ponderar y equilibrar las cosas para tener una gobernabilidad, la misma que desde que llegó la 4T , no ha hecho más que polarizar a los mexicanos para generar una atmosfera de crispación de alta perversión política para enfrentar a los mexicanos y sacar provecho de esa división, cubrir la enorme corrupción e impunidad en la enorme estela de narcoterrorismo en el país.
Y tercero, la enorme falta de respeto del secretario de la defensa nacional, el general Ricardo Trevilla, de decir que le brindaban a Carlos Manzo "vigilancia periférica'; fíjense nomás el concepto y la ocurrencia del jefe de la milicia en México, de que le brindaron "vigilancia periférica", lo cual no tiene palabras para criticar este este tema, pues si en verdad hubiera sido tal, porque ingresaron y rompieron los delincuentes esa vigilancia periférica y no se coordinaron con la Policía Municipal, porque la estatal con un gobernador tan irresponsable como Alfredo Ramírez Bedolla, de Morena, no había sido igualmente posible.
Y un cuarto punto que llama muchísimo la atención: ni la presidenta ni los demás dijeron el nombre Carlos Manzo; hablaron del alcalde de Uruapan, del señor alcalde, pero nunca mencionaron el nombre de Carlos Manzo, ni para eso fueron capaces ni la presidenta ni el general secretario de la defensa ni García Harfuch, de mencionar el nombre del principal político, así fuera de una modesta alcaldía como la de Uruapan, en denunciar al narcotráfico en el país y directamente la responsabilidad hacia la presidenta Claudia Sheinbaum. Así fue la reacción del gobierno de la 4t más lamentable no hubiera podido ser en lugar de actuar de manera diferente...

Tras 13 años del sexenio de Calderón, la 4T sigue culpándolo de la inseguridad
A pesar de que Morena cuenta con 7 años en el poder de la federación, los personajes políticos de la 4T, incluida la presidenta Claudia Sheinbaum, siguen culpando a Felipe Calderón de la inseguridad en el país. Esta mañana tras el asesinato del presidente municipal de Uruapan, Carlos Manzo, expuso que a la derecha se le ha olvidado la historia y la guerra contra el narco de Felipe Calderón.
“Seis años de fracaso de una estrategia, peña nieto envió un comisionado y decidió armar autodefensas con una estrategia similar a la que se dio en otros países de américa latina y no funcionó… La intervención, no. México es un país libre y soberano”, dijo durante rueda de prensa.
A esto se le suman comentarios a nivel local como el Presidente del Consejo Estatal de Morena, Hugo González, quien arremetió contra Calderón y los gobiernos panistas, “Qué los panistas no se hagan tontos, porque ha sido durante sus gobiernos, cuando peor le ha ido a México en temas de inseguridad”, dijo.

Marcharán panistas por la familia, la patria y la libertad este domingo
Los panistas en Chihuahua convocan a una marcha en el Parque Lerdo el domingo 9 de noviembre.
Esto ocurre en el marco del relanzamiento del Partido Acción Nacional en la promoción del eslogan en defensa de la familia, la patria y la libertad.
El encuentro de los militantes y simpatizantes del PAN tendrá verificativo en punto de las 11 horas.

Comienza la distribución de carne proveniente de Brasil en Chihuahua
Trascendió que en el estado ya hay carne a la venta proveniente de Brasil, la foto captada muestra un pedazo de carne congelada con el nombre de la empresa brasileña PUL, esto en Ciudad Cuauhtémoc.
Además de la ciudad sureña, también en Chihuahua se han visto estos paquetes en algunos establecimientos como “CarneMart “y demás carnicerías, esto al existir una falta de oportunidad hacía los productores mexicanos.
Con la crisis del gusano barrenador los pequeños ganaderos se han visto afectados y hoy en día, en vez de darles oportunidad dentro del comercio local, son sustituidos por productos sudamericanos y los pocos grandes productores mexicanos.
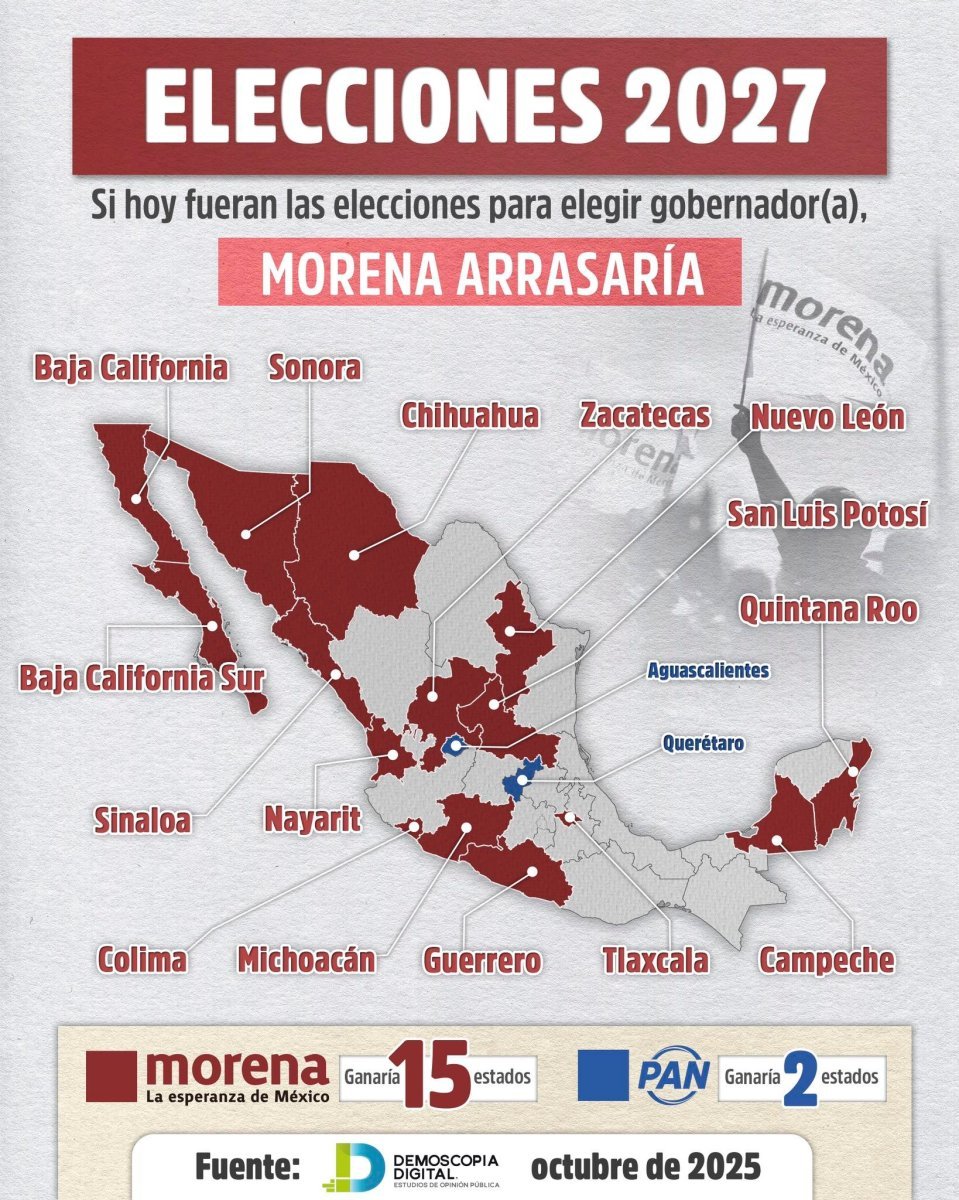
Luisa Alcalde señala que Morena arrasaría por la gubernatura de Chihuahua
La presidenta nacional de Morena, Luisa María Alcalde, señaló que si hoy fueran las elecciones, Morena arrasaría en 15 de las 17 gubernaturas, incluyendo la de Chihuahua.
Publicó en redes sociales: De acuerdo con las últimas mediciones, así luce el panorama de cara al proceso electoral de 2027. Si hoy fueran las elecciones, nuestro Movimiento triunfaría en 15 de los 17 gobiernos estatales en disputa. Todo nuestro agradecimiento al pueblo de México por su confianza. No la vamos a traicionar.

Cruz sigue la línea de otros candidateables sobre promoción en bardas, “seguramente fueron amigos”, dice
Tras la aparición de una serie de pintas promocionando al alcalde de Juárez, Cruz Pérez Cuéllar, el edil respondió que desconoce quien las haya puesto.
Pérez Cuéllar siguió la línea de los demás actores políticos a los que se les ha cuestionado sobre su promoción en bardas dentro de la ciudad de Chihuahua, “seguramente han de ser algunos amigos, no sé”, se limitó a decir, pero confirmó que si las vio.
Son varios los personajes que ya comenzaron con la promoción en varias zonas del estado, tan solo en Chihuahua se han visto pintas de Marco Bonilla, Alfredo Chávez, Daniela Álvarez , César Jáuregui y el mismo Cruz, otros mas como Andrea Chávez, reparten café con su imagen, y otros tantos, crean “paginas de fans” en redes sociales para llamar la atención del electorado.

Circula imagen de Gustavo Madero con tarjeta del Bienestar
Un imagen que ha circulando, muestra al ex senador del PAN, Gustavo Madero, con la tarjeta de la pensión del Bienestar.
Gustavo Madero votó a favor de elevar a rango constitucional los programas sociales, sin embargo siempre criticó su uso con fines electorales.
La imagen ha sido bastante comentada, ya que circula en el momento en el que el PAN se divorcia del PRI, y cuando la nueva agenda del relanzamiento ha causado polémica, entre ellos el abrirse a la defensa del matrimonio igualitario como catalogo de familia.

Andrea Chávez lanza sus vasos de café "personalizados"
Se comenta en redes sociales que la senadora de Morena, Andrea Chávez Treviño, ya lanzó su propio café, con todo y vasos personalizados, algo que para muchos es para hacer competencia a la bebida oficial del Bienestar.
Andrea Chávez aparece en sus redes sociales entregando "pan y café" a la clase trabajadora en Ciudad Juárez.
Los vasos del café de Andrea Chávez muestran su nombre, la imagen de una sombra de una mujer portando un sombrero y la leyenda "Buenos días Juárez".

Estados Unidos investiga a Pablo Lemus por presuntos vínculos con CJNG
El periodista Raymundo Riva Palacio aseguró que el gobernador de Jalisco, Pablo Lemus, esta siendo investigado por los Estados Unidos por supuestos vínculos con el cartel Jalisco Nueva Generación y su relación con Nazario Ramírez, líder de transportistas.
Según su columna en El Financiero, tras la detención de Ramírez por supuesto lavado de dinero y narcomenudeo salió a relucir una fotografía en donde aparecen el gobernador y el líder transportista, lo que detonó una serie de especulaciones en donde se señala al gobernador de haber recibido dinero del líder transportista y el cartel de narcotráfico.
Pero lo que trascendió fue que los Estados Unidos comenzaron una investigación sobre Lemus y posible participación en actos ilícitos que irían de la mano con Ramírez y con el CJNG, lo que lo colocaría como uno de los 300 nombres de políticos y empresarios que están siendo investigados por el país vecino.

Lilia e Irlanda rinden informe sin América
Se supone que América Aguilar es la presidenta del PT en Chihuauhua y fue excluida de sus propias diputadas en un informe de labores presentado en Ciudad Juarez.
Las diputadas del Partido del Trabajo, Lilia Aguilar Gil e Irlanda Márquez Nolasco, presentaron de manera conjunta su informe legislativo, excluyendo de este acto a la pluri América Aguilar.
La diputada Irlanda Márquez Nolasco, fue presentada como la representante del PT en el Congreso de Chihuahua, lo que da a entender lo que ella dijo, que es la única diputada del petismo, no América.
Aun por mero protocolo debió invitarse a la que se supone es la presidenta del PT en Chihuahua, América Aguilar; pero no fue así. Es más América no ha presentado su informe en público.

Políticos Chihuahuenses presentes en el relanzamiento del Partido Acción Nacional
Con el relanzamiento del partido Acción Nacional, políticos Chihuahuenses se dieron cita en la Ciudad de México para estar presentes en el evento y marcha que se espera esta mañana.
En el evento de reunión de militantes y ciudadanos afines al blanquiazul, no faltaron los personajes del estado grande, entre ellos el alcalde Marco Bonilla, el diputado Alfredo Chávez, la presidenta estatal Daniela Álvarez, la líder juvenil Daniela Aguilar y la gobernadora Maru Campos, quien fue recibida con aplausos y porras al presentarla.
Se espera que después del mitin en el foro Frontón, los asistentes se den cita para marchar en la capital del país.

La pancarta de Rocío González en la Cámara
Destacó a nivel nacional que una de las legisladoras del PAN que portó una enorme lona con la imagen de Sheinbaum silenciando con dedo en su boca a la población afectada por la inundación en Veracruz que le exigía atención, fue la diputada por Chihuahua, Rocío González.
La diputada federal por Chihuahua, salió a primer cuadro en los principales noticieros del país, con una lona muy distinta al tema de la discusión legislativa.
Se discutía la reforma a la Ley de amparo, y Rocío González, llevó hasta la tribuna del Congreso Federal una luna donde se ve a Claudia Sheinbaum recurriendo al “shh” como la onomatopeya, silenciando a la población en Veracruz desde una pick up y custodiada por elementos militares, además de amenazar con irse si no se callaban.
La aparición a cuadro de Rocío González se dio con el tema de la reforma a la Ley de Amparo, mientras se sentenció que la 4T primero alegaba que el problema eran los jueces, ahora que la figura es el amparo, que eso es lo que estaba mal y donde la principal autora de este revés a la defensa ciudadana es la presidenta Claudia Sheinbaum con su “cereza en el pastel”.

A casi un año de que Riggs ejerciera violencia política de género vs la Síndica, pide disculpas
Desde el pasado 14 de enero del presente año, un bochornoso hecho marcó al Gabinete Municipal, pues durante una comisión el regidor Miguel Riggs, realizó una serie de comentarios contra la sindica Olivia Franco, mismos que fueron catalogados como violencia política de género, y fueron denunciadas y reprobadas por la fracción de Acción Nacional.
A casi un año, el día de ayer el mismo Riggs, ofreció una disculpa, esto en cumplimiento a la resolución emitida por el Tribunal Estatal Electoral, aunque fueron aceptadas, la misma Olivia, indicó que le hubiera encantado que se dieran de manera privada y con voluntad personal.
También en el caso el TEE ordenó la inscripción de Miguel Riggs en el Registro Nacional de Personas Sancionadas en Materia de Violencia Política contra las Mujeres en Razón de Género, como parte de las medidas de reparación integral.
Y se instruyó notificar el caso al Órgano Interno de Control del Municipio y al Instituto Chihuahuense de las Mujeres, encargado de vigilar el cumplimiento de las medidas de protección en favor de la funcionaria.

Bautizan a Miguel Riggs, el regidor "iRiggsponsable"
El dirigente municipal del PRI, Pedro Beristaín, al desmentir a Miguel Riggs sobre una calle en proceso de pavimentación, le bautizó como el "Regidor IRiggsponsable".
En la colonia Juan Huereca, en la calle privada Fierro, en días pasados el regidor de Morena, Miguel Riggs grabó un video denunciando la falta de pavimentación y señaló que el Consejo de Urbanización Municipal no ha hecho su trabajo.
Pedro Beristaín al ir a revisar este tema confirmó que dicha pavimentación es bipartita entre municipio y vecinos, es decir 50% y 50%. "Vino a grabar un video desinformando y calumniando como es su costumbre... es una vil mentira y completamente falso, al día de hoy los vecinos, en la parte que les toca aportar, que es el 50% de la obra, únicamente han pagado 29 mil pesos al 13 de junio del año pasado, que es el último pago registrado, lo cual corresponde cerca del 22 o 23%", señaló Pedro Beristaín.
Señaló que políticos irresponsables como Miguel Riggs se dedican a calumniar y mal informar a los ciudadanos con intereses electorales, "te vamos a llamar en el PRI el regidor iRiggsponsable. Porque lo único que haces es calumniar, difamar y mentir, repito, para ganar adeptos. Te invitamos a que seas más responsable, a que seas más profesional, a que hagas política de altura, pero sobre todo que no le mientas a las y los chihuahuenses porque es lo último que se merecen de políticos como tú".

Le brotan conflictos a la 4T por todas partes
Con las movilizaciones de esta mañana a nivel nacional tanto de campesinos como del estallamiento del conflicto de los trabajadores del SAT, se devela que parte de las instancias de gobierno de la 4T están en crisis, conflictos que se suman al caos por las inundaciones en cinco entidades bajo la inoperancia del gobierno y a la cotidianidad de las masacres, robos y extorsiones del crimen organizado.
Ya desde la semana pasada comenzaron las movilizaciones de personal sindicalizado del Monte de Piedad, que estallaron la huelga por la denuncia de los abusos de la administración, que quiere terminar con el contrato colectivo de los trabajadores, además del no aumento de sueldo. Manifestaciones que, por cierto, siguen en pie.
Por otro lado, esta mañana comenzó un paro nacional de trabajadores del SAT, quienes aseguran que hay incertidumbre en el empleo y existe una falta de aumento salarial. Por si fuera poco, hoy también se unen a las manifestaciones de agricultores que demandan, se atienda al campo y se retiren los granos del T-MEC y se de revisión a la tan presumida ley general de aguas, pues aseguran que lo derechos que ya se tenían no se pueden retirar.
Los problemas crecen día a día en diferentes frentes, ante la narrativa del gobierno de minimizarlos, además del rostro incontable de la corrupción entre sus principales personajes, hoy por hoy envueltos en toda clase de escándalos...
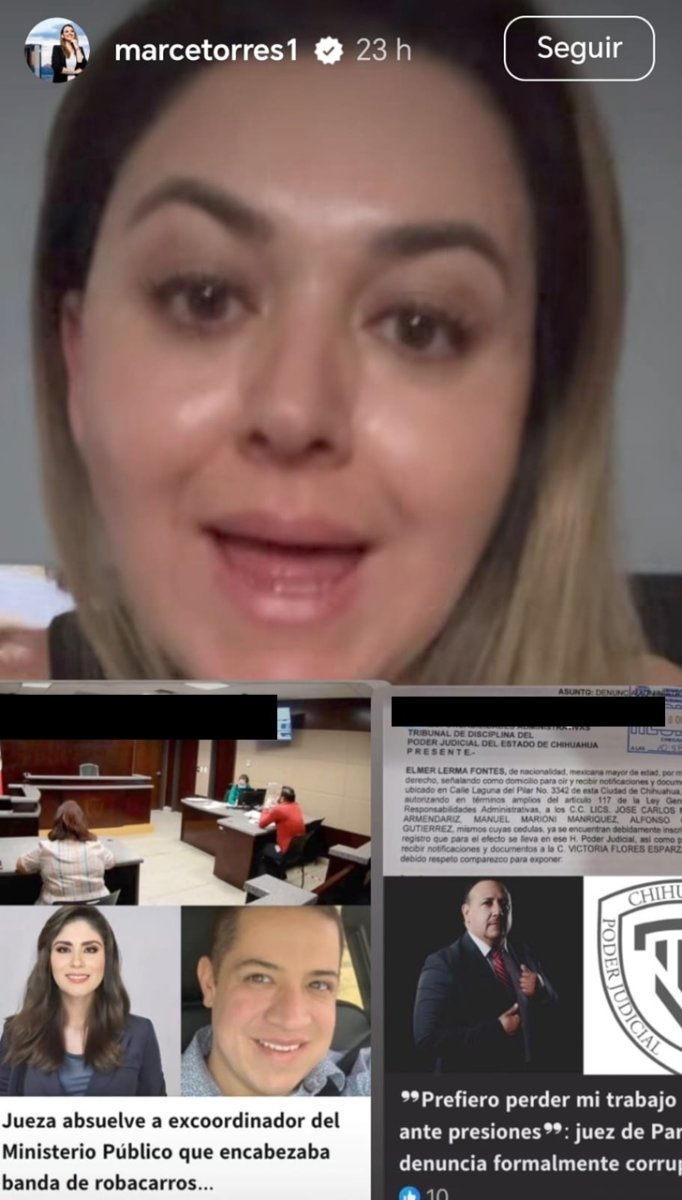
Abogada Torres le pone marcaje en redes a la corrupción en el TSJ
La abogada Marcela Torres advirtió que habrá de exhibir los presuntos actos de corrupción dentro del Poder Judicial de Chihuahua.
A través de redes sociales, junto a la denuncia que presentó el juez Elmer Lerma de las presuntas presiones en el caso del hermano del diputado Ramírez, la abogada sentenció “No puedo una tras otra en el Poder Judicial de Chihuahua, y de verdad, no estoy haciendo un escándalo porque estoy tratando de tener paciencia y creer que en el tribunal van a hacer algo, la presidenta, el tribunal de disciplina, o sea, ni siquiera estoy etiquetando, pero estoy a una de empezar a hacerlos en reel”, dijo.
Sentenció que etiquetarlos será una diferencia mayor “lo único que les puedo decir es no puedo quedarme callada. O sea, si la gente piensa de que no voy a decir nada porque conozco gente en el tribunal, no me voy a quedar callada nunca, por supuesto que si veo que empiezan a hacer su trabajo, yo también aquí lo resaltaré como lo he resaltado, no por partidos, lo he resaltado con los ministros de la corte, lo he resaltado”.
“Si veo que el tribunal está haciendo algo, también lo voy a mencionar, haciendo algo para ver esta corrupción, porque es evidente que, o sea, me voy a esperar”, agregó.
https://www.instagram.com/stories/marcetorres1/3741303831100794877/?utm_source=ig_story_item_share&igsh=dzFzdzh2cHFtaHo1#

Regidores presumen foto en “La Cerve”
Llamó la atención que el regidor de Morena Hugo González, presumió en sus redes sociales una fotografía con el regidor panista Isaac Díaz, en la tradicional Cervecería de Chihuahua.
Esto horas más tarde de que el regidor González, presentara su informe de gobierno y en este solo resaltará que el alcalde Marco Bonilla, solo se dedique a beneficiar a sus “compadres”.
Dicen, que mientras que el alcalde responde a estos ataques, los miembros de su misma fracción disfrutan conversando con el enemigo.
y quién no niega la cruz de su parroquia es Yamil Athie, pues dicen no niega la bendición de Morena y de haber llegado al Poder Judicial con el acordeón que manejó el alcalde de Juárez Cruz Pérez Cuéllar.

Reaparece Sergio Ramírez, al lado de Kenia López Rabadán
Llamó la atención que, más que la observación de los propios panistas, hayan sido algunos legisladores locales de oposición los que se percataron de que, como jefe de prensa de la presidenta de la Cámara de Diputados, Kenia López Rabadán, haya aparecido un personaje que sin duda atrajo especialmente la atención por sus antecedentes, como es el caso de Sergio Ramírez, quien fuera efímeramente coordinador de Comunicación Social del Gobierno del Estado cuando sucedió a René Sotelo en el encargo y quien duraría escaso tiempo debido a los graves problemas que se registraron en cuanto al acoso sexual y también algunos problemas de objetivos en esa área tan importante no alcanzados, según se dio a conocer en su momento dentro de las propias fuentes de gobierno.
La manera en que la gobernadora Maru Campos cesó de manera tan tajante, con un manotazo definitivo, la presencia de Sergio Ramírez al frente de un área tan importante como Comunicación Social, llamó desde luego poderosamente la atención y fue incluso un tema que alcanzó algunos contactos a nivel nacional, porque no se debe olvidar que Sergio Ramírez es parte del grupo del llamado "gurú de la comunicación del PAN", Max Cortázar, un personaje que ha sacado gran tajada en los cuatro estados en los que gobierna Acción Nacional con toda una serie de negocios de consultoría y de otras cosas que se le señalan principalmente por la competencia política, como se ha dado a conocer esto allá mismo en la Cámara de Diputados…
Citan las fuentes que Sergio Ramírez, en un grado extremo de haber acosado a varias mujeres estalló el problema y se hizo crítico cuando una reportera de Cuauhtémoc denunció directamente ante la gobernadora la manera en que este personaje la había acosado. En ese entonces, Maru no dudó ni un instante y no solamente lo cesó, sino que le impidió ya ingresar a sus oficinas en Comunicación Social, provocando que la acción se hiciera muy notoria en aquel momento.
Ramírez no cumplió ni el año al frente de la dependencia y fue rescatado, como se reporta, por el grupo de Cortázar, quien en varios estados ha causado problemas porque se erige prácticamente como el gobernador o quien sugiere y manda en otras áreas políticas, como ha sucedido en Chihuahua, donde algunos frentes simplemente lo han rechazado por la manera soberbia y de gurú que tiene, como mucha gente del centro, de venir aquí a adorar la píldora o a vender los espejitos.
Como en este caso, la consultoría de comunicación social le aparece a este personaje entonces al frente de la comunicación en gobierno, y quién sabe si esto pueda lastimar o crear un problema en los vínculos tan fuertes de influencia que tiene Maru Campos a nivel nacional en el PAN, donde es uno de los activos más importantes que tiene este partido, o si fue consultada para que Ramírez, después de lo que hizo en Chihuahua, accediera a un espacio de ese nivel al lado de Kenia López, quien hace poco, por cierto, estuvo en el Estado y quien es ahora la presidenta de la Cámara de Diputados para el actual periodo.

Entre risas de asistentes, Sheinbaum asegura que hay libertad de expresión en la mañanera
De nueva cuenta el tema del favoritismo dentro de la mañanera salió a relucir y es que una de las periodistas presentes en la rueda de prensa de esta mañana cuestionó sobre el dinero que ha invertido el gobierno federal en publicidad dentro de medios de comunicación, “¿existe el favoritismo?, ¿los recursos son discrecionales?”, cuestionó a la presidenta Claudia Sheinbaum.
Rápidamente la presidenta respondió a su pregunta comentando que si puede haber transparencia en la inversión, pero aunque no sean beneficiados por el gobierno federal, a todos se les da la palabra, “díganme a quien no le hemos dado la palabra, a todos les hemos dado la palabra, a nadie se le corta aunque tome media hora, cinco o diez minutos, a todas y todos se les da la palabra… así que digan que imparcialidad, pues no creo”, aseguró Sheinbaum mientras los reporteros de diferentes medios se reían.
Aseguró que, a compañeros de Reforma, Uno Tv, medios tradicionales y alternativos se les da la palabra e inclusive comentó que nada tenía que ver lo invertido en los gobiernos de la 4T con los 10 mil mdp que se destinaban en el gobierno de Peña Nieto.

Presiones hacía Juez por caso de “El Chino” Ramírez se dieron por parte de la Fiscalía
Trascendió que las presiones hacia el Juez Elmer Lerma por del caso de “El Chino” Ramírez quien atentó contra la vida de Eloy Soto y que baleó a dos abogados, quienes también son primos-hermanos del implicado, vinieron de la Fiscalía General del Estado y no por parte de algún magistrado.
Esto se da después de que en redes sociales y medios digitales se difundiera un video en donde el mismo Juez expone que las autoridades deben de hacer bien su trabajo y hacerlo jurídicamente, “No deben de utilizar ningún medio extrajurídico, deben de ser diligentes, hagan su trabajo bien… ustedes saben a que me refiero, no necesitan estar haciendo cosas que no deben”, comentó en el video.
Fue el 29 de septiembre cuando ocurrió este hecho en la ciudad de Parral, cuando atacaron a dos abogados en un funeral, hoy el presunto responsable Fernando R. se encuentra detenido.

Video: Sacan "bachata" de Adán Augusto, "la Barredora" y el "Huachicol"
A través de las redes sociales se estrena una nueva canción en "bachata" dirigida a Adán Augusto López, donde se relata la caída política que tuvo el hoy coordinador de los senadores de Morena.
En el single señala que Adán Augusto "lo tenía todo", pero "por corrupto terminó en el lodo".
Se le describe como un personaje que sólo busca el "poder y dinero", así como de incurrir en delitos, entre ellos que, "el huachicol lo tiene acabado", de haber "entregado Tabasco a la barredora.
Se canta la caída política de Adán Augusto y que le ha dado la espalda el ex presidente Andrés Manuel López Obrador.
Cheque el link:

De la Peña se une a los panistas y lanza encuesta telefónica
Otro político salió a relucir por la difusión de su persona entre los Chihuahuenses, y es que ahora el Secretario de Gobierno, Santiago de la Peña, comenzó su campaña de encuestas, uniéndose al grupo del diputado Alfredo Chávez y el secretario Rafael Loera.
Y es que en los últimos días ciudadanos se percataron que los blanquiazules comenzaron a utilizar este método de encuesta para medir el apoyo de los electores y así contender, ya sea por la alcaldía o la gubernatura, como es el caso de Santiago De la Peña.
A pesar de que De la Peña sonaba para una alcaldía, al parecer ya le tiró mas alto y decidió que siempre si va por la candidatura para gobernador, pero aun hay que ver si la gente lo respalda…
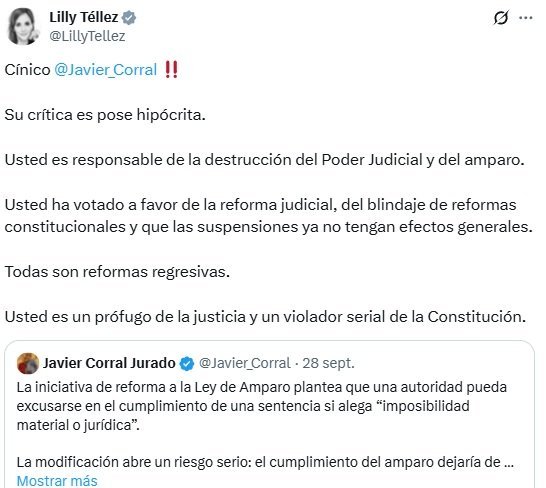
Llama Lilly Téllez a Javier Corral "prófugo" y "violador serial de la Constitución"
La senadora del PAN, Lilly Téllez, señaló al ex gobernador Javier Corral asegurando que "es un prófugo de la justicia y un violador serial de la Constitución".
A través de su cuenta de Twitter, Lilly Téllez se pronunció en contra del comentario de Javier Corral sobre la iniciativa de reforma a la Ley de Amparo.
Según el ex gobernador de Chihuahua, señala que el permitir que una autoridad pueda excusarse en el cumplimiento de una sentencia si alega “imposibilidad material o jurídica”, "abre un riesgo serio: el cumplimiento del amparo dejaría de ser una obligación plena y pasaría a depender de la apreciación de la propia autoridad responsable. Esto debilita la fuerza del amparo como medio de control constitucional, pues cualquier sentencia podría quedar sin ejecución si la autoridad alega falta de recursos, obstáculos administrativos o trabas legales. El juicio de amparo está diseñado para ser un recurso efectivo, tal como lo exige el artículo 25 de la Convención Americana de Derechos Humanos. Si se fomentan excusas para no cumplir sus sentencias, podría convertirse en un recurso simbólico sin efecto alguno en la vida de las personas. De ser así, el amparo perdería su razón de ser: proteger a las personas frente a abusos de autoridad. Es claro, las sentencias de amparo deben cumplirse, no litigarse".
Lilly Téllez le comentó " Cínico @Javier_Corral Su crítica es pose hipócrita. Usted es responsable de la destrucción del Poder Judicial y del amparo. Usted ha votado a favor de la reforma judicial, del blindaje de reformas constitucionales y que las suspensiones ya no tengan efectos generales. Todas son reformas regresivas. Usted es un prófugo de la justicia y un violador serial de la Constitución".

Lanzan encuesta telefónica a favor de Rafael Loera para la alcaldía de Chihuahua
A primera hora de este sábado algunos usuarios comenzaron a recibir llamada de una encuestadora a favor del Secretario de Desarrollo Humano y Bien Común Rafael Loera, donde lo que más llamaba la atención es que una de las preguntas era sí usted votaría por él para la alcaldía de la Capital.
Así mismo otras cuestiones como, ¿de dónde lo conoce?, ¿cómo califica su desempeño?, pero todo relacionado a él y sin mención de otra cosa más que dar a conocer su nombre y su perfil.
Lo que preocupa es que esta encuesta sale días después de que la Gobernadora María Eugenia Campos, lanza un mensaje y donde pide a los futuros aspirantes a tener respeto ya que faltan dos años para la sucesión, y pues lo mismo debería de pasar en la alcaldía ya que para que Marco Bonilla, abandone el barco faltan dos años.
Y es que eso no es todo, dicen, que extrañamente todos salen al destape, luego de que la Dirigente Estatal del PAN Daniela Álvarez, comenzará con la pinta de bardas y espectaculares por el Municipio, y posteriormente aparecieran bardas a favor del diputado Alfredo Chávez, ¿será que en esta ocasión Loera, si sepa quién lanzó esta campaña?
La pregunta aquí es ¿con qué recurso se paga la propaganda?, y es que de acuerdo a los datos una campaña de esta índole ronda entre los casi 8 mil pesos para un alcance solamente de 10 mil personas, y varia depende del contenido y diversos factores, por lo que podría ser más costosa.





















































